近日,欧盟MDCG发布《隐形眼镜Master UDI-DI解决方案的实施指南》,在结构、分配、标签和注册等方面为隐形眼镜实施Master UDI-DI规则提供指引。接下来,让医疗质量检测技术展为您详细介绍。
隐形眼镜是呈现高度个性化的器械,根据MDR 2017/745附件VI的C部分第6.6.1节,以及欧盟授权法规(EU)2023/2197对隐形眼镜Master UDI-DI的修订,规定了其Master UDI-DI的分配。

关于Master UDI-DI
Master UDI-DI是用于分组某些高度个性化器械的唯一标识符。前述高度个性化器械在预先定义的临床参数方面表现出特定相似性(例:应该为具有相同设计参数组合的隐形眼镜单独分配Master UDI-DI,包括但不限于基弧和直径)。
作为访问一组有相同预期用途和主要设计的器械的信息访问键,Master UDI-DI被存储在Eudamed中,其分配应遵循欧盟指定发行实体的规则,应当和Basic UDI-DI相关联。
Basic UDI-DI(BUDI)和Master UDI-DI(MUDI)的分配层次不同于UDI-DI的分配。在下图中,每个子框都将被分配一个UDI-DI,从而产生大量的UDI-DI,这不仅不符合实际,还会带来不必要的麻烦,对当局和经济活动者不产生任何附加价值。
在分组级别上分配Master UDI-DI,对应于图中从上向下数的第二行将更为合适。

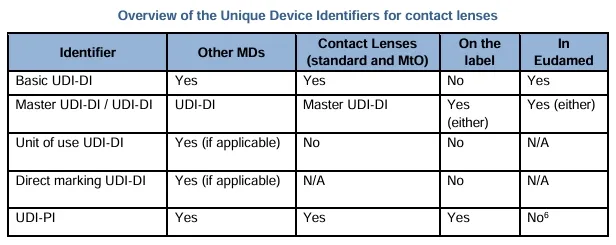
下表比较了将UDI-DI分配给隐形眼镜和其他器械所给出的不同设备标识符和识别级别:
Master UDI-DI的强制执行时间
关于隐形眼镜Master UDI-DI的欧盟授权法规(EU)2023/2197于2023年10月20日在欧盟官方公报OJEU上发布,已于2023年11月9日生效,从其生效到强制性指定规定有2年的过渡期,即:自2025年11月9日起正式实施。
关于Master UDI-DI分配的法规被强制执行前,未分配Master UDI-DI的隐形眼镜可以投放市场,但是制造商可以为不同的标识目的分配其他类型的标识符(例如GTIN或其他标准),或在自愿的基础上分配Master UDI-DI。
在Eudamed注册隐形眼镜的义务应从强制使用UDI/器械注册模块的过渡期到期时开始适用。遗留隐形眼镜可使用等效的Eudamed ID和Eudamed DI在Eudamed中注册,用于严重事件报告,而无需指定Master UDI-DI或其他标识符。
👉对医械制造商而言,知晓并遵守UDI适用要求以确保患者安全并避免被处罚,显得尤为重要。
文章来源: 久顺集团技术服务
若涉及侵权,请立刻联系删除
关键字:









